Il Nobel per la medicina agli scopritori del virus dell’epatite C
Mentre il mondo sta combattendo contro SARS-CoV-2, il Nobel per la medicina di quest’anno premia i tre studiosi che hanno scoperto il virus dell’epatite C. Un lavoro di squadra durato quasi cinquant’anni che ha salvato milioni di vite
di Giuliana Raffaelli e Cristiana Ragano Caracciolo
Il 5 ottobre la Nobel Assembly del Karolinska Institute in Svezia ha assegnato il Nobel per la medicina agli statunitensi Harvey J. Alter e Charles M. Rice e al britannico Michael Houghton per la scoperta del virus dell’epatite C. La scoperta dei virus dell’epatite A − infezione trasmessa da acqua e cibo contaminati − e dell’epatite B − trasmessa con i liquidi biologici come il sangue − seppur di fondamentale importanza, aveva lasciato non completamente chiuso il capitolo delle infezioni trasmesse con il sangue. La scoperta del virus dell’epatite C ha permesso di salvare milioni di vite grazie alla possibilità di avere test e terapie specifiche. Ripercorriamo la storia di questa scoperta premiata con il Nobel.
BREAKING NEWS:
— The Nobel Prize (@NobelPrize) October 5, 2020
The 2020 #NobelPrize in Physiology or Medicine has been awarded jointly to Harvey J. Alter, Michael Houghton and Charles M. Rice “for the discovery of Hepatitis C virus.” pic.twitter.com/MDHPmbiFmS
Harvey James Alter, newyorkese di origine ebraica, nasce nel 1935 e nel 1960 si laurea in medicina alla School of Medicine dell’Università di Rochester. Fin dall’inizio la sua carriera si intreccia con le epatiti, infatti collabora con Baruch Blumberg (Nobel per la medicina nel 1976 con Daniel Carleton Gajdusek), scopritore del virus dell’epatite B (1967) cui si devono anche il test diagnostico e il vaccino. Dal 1969, lavora al National Institute of Health (Nih) nel Dipartimento di Medicina Trasfusionale, analizzando campioni di sangue usato per le trasfusioni per scoprire le cause delle epatiti a esse associate. A metà anni Settanta, Alter e i suoi collaboratori dimostrano che la maggior parte delle epatiti post-trasfusione non sono correlabili ai virus A e B; si parla, dunque, di una nuova forma di epatite “non-A non-B” (Nanbh). Il primo tassello è posto.
Per un decennio si fanno infruttuose ricerche per identificare il nuovo organismo, fino a quando, nel 1987, un virologo londinese, classe 1949, ispirato a intraprendere questa carriera dalla lettura delle pubblicazioni di Louis Pasteur, fa un enorme passo avanti. Michael Houghton, dal 1982 alla Chiron Corporation (California), e Daniel W. Bradley dei Centers for Disease Control and Prevention (Cdc), usano una tecnica che prevede la replica e la ricombinazione delle molecole di Dna, la clonazione molecolare, per identificare il microrganismo ignoto e sviluppare un test diagnostico specifico. I ricercatori usano frammenti di Dna presi da uno scimpanzè infetto ritenendo che contengano anche il genoma del microrganismo sconosciuto. Partendo poi dal presupposto che nel sangue dei soggetti infetti da Nanbh siano presenti anche gli anticorpi, i sieri vengono fatti reagire con il Dna prelevato dallo scimpanzè e alla fine si identifica un nuovo virus, appartenente alla famiglia Flaviviridae, il cui materiale genetico è costituito da acido ribonucleico, Rna. Il virus sarà poi chiamato virus dell’epatite C (Hcv).
Nel 1988 arriva la conferma dell’esistenza del virus quando Alter ne verifica la presenza in alcuni campioni classificati come Nanbh e nel 1989, sulla rivista Science, vengono pubblicati due articoli che annunciano la scoperta del virus dell’epatite C. Tra il 1989 e il 1990 Houghton conduce altri studi che portano all’identificazione degli anticorpi dell’epatite C nel sangue e che rappresentano la base per lo sviluppo di un test di screening, reso poi ancora più sensibile nel 1992. E i ricercatori dimostrano anche che l’epatite C è collegata al tumore del fegato, l’epatocarcinoma.
All’inizio del nuovo secolo arriverà il primo riconoscimento per Alter e Houghton, il Lasker Award for Clinical Medical Research, per “il lavoro pionieristico che ha portato alla scoperta del virus che causa l’epatite C e lo sviluppo di metodi di screening che hanno ridotto il rischio di trasfusione di sangue infetto da epatite negli Stati Uniti dal 30% nel 1970 quasi a zero nel 2000”.
La scoperta oramai è fatta, ma rimane ancora da chiarire se questo virus da solo è in grado di replicarsi e causare la malattia. Fa la sua comparsa in questa affascinante storia, il secondo americano dell’illustre terzetto, Charles Moen Rice. Anche lui virologo, nasce nel 1952 in California, a Sacramento; nel 1981 consegue il dottorato di ricerca al California Institute of Technology e nel 1986 nasce il suo gruppo di ricerca alla Washington School of Medicine di St Louis. Dal 2001 sarà alla Rockfeller University di New York, dove, fino al 2018, è Direttore scientifico ed esecutivo del Centro studi dell’epatite C.
A St Louis, Rice e i suoi collaboratori notano che nella parte finale del materiale genetico del virus c’è una regione che ritengono importante per la sua replicazione, tanto che alterazioni genetiche in tale sede potrebbero ostacolarla. Con l’ausilio dell’ingegneria genetica, i ricercatori producono una variante di questa porzione di Rna priva di modificazioni genetiche che possono inattivarla e quindi lo iniettano nel fegato degli scimpanzè. Nel fegato degli animali infettati si osservano cambiamenti patologici simili a quelli che si verificano nel fegato di pazienti con malattia cronica. È il 1997 quando Rice coltiva il primo clone infettivo del virus dell’epatite C. Questa è la prova finale che tale virus, da solo, può causare i casi di malattia mediati da trasfusione.
Questo lavoro, partito all’inizio degli anni Settanta con Alter, ha portato a una scoperta sensazionale e il premio è il meritato coronamento di una storia così ricca che ha coinvolto più persone dimostrando l’importanza del lavoro di squadra. Le reazioni dei vincitori ovviamente non potevano essere da meno. La chiamata, anzi le tre chiamate, che hanno svegliato Harvey Alter nel cuore della notte (la prima intorno alle 4.45 sulla costa est degli Stati Uniti) lo hanno fatto un po’ arrabbiare, ma la rabbia si è rapidamente trasformata in shock quando rispondendo alla terza telefonata ha compreso che “…era Stoccolma” e così quella chiamata è diventata “…la migliore sveglia che abbia mai avuto”.
Micheal Houghton, in Canada, ha invece rinunciato a poter riprendere sonno dopo la chiamata, alle 3 del mattino, da parte di un suo amico che aveva appena appreso la notizia. Il suo pensiero è andato alla quantità di lavoro che ha richiesto riuscire a clonare il virus: almeno 30 approcci diversi in 7-8 anni, un tempo misurato con la costruzione di alberghi “penso che abbiano dovuto erigere circa 10 hotel prima che finalmente lo trovassimo!”.
Ma in un momento come questo, in cui stiamo combattendo la battaglia con un altro virus, sono le riflessioni di Micheal Rice che riportano all’essenza e all’importanza della ricerca scientifica. Le sue parole, subito dopo aver saputo del premio, sono state “Non ci impegniamo in queste attività per ricevere premi”. E parlando della ricerca che tutto il mondo sta facendo su Sars-CoV-2 (l’analogia con la scoperta del virus dell’epatite C è innegabile) continua “…ti mostra cosa si può fare se le persone si mobilizzano e lavorano insieme portando diverse competenze per risolvere un problema comune”.
Speriamo che questo Nobel e le parole di Rice siano di buon augurio.
Parola all’esperto
Parla Gloria Taliani, professore ordinario di Malattie Infettive presso Sapienza Università di Roma, la cui area di interesse principale è rappresentata dalle epatiti virali.
Il Nobel per la medicina di quest’anno è stato assegnato ai tre scienziati Alter, Houghton e Rice che hanno scoperto il virus dell’epatite C e permesso così di arrivare a test diagnostici e farmaci mirati. Ancora oggi, tuttavia, l’Oms riporta che questa patologia colpisce ogni anno 70 milioni di persone e ne uccide 400.000. Ci può spiegare di che tipo di malattia si tratta? In altre parole, cos’è l’epatite C?
“L’epatite C è una malattia per alcuni aspetti molto insolita. Innanzitutto, è causata da un virus a Rna e si può manifestare con una fase acuta che può o risolversi o causare la morte del paziente, qualora si tratti di una forma fulminante. Ma quello che si è scoperto è che questo virus può causare una malattia cronica, un’anomalia per i virus a Rna che strutturalmente, ossia per motivi biologici legati ai cicli di replicazione che per l’incapacità di integrarsi al Dna della cellula dell’ospite, non sono capaci di dar luogo a malattie croniche. Questo virus, invece, utilizzando lo stratagemma molto astuto di cambiare continuamente il suo rivestimento di superficie, sfugge al controllo immunitario e determina uno stato di infezione durevole che ha tutte le caratteristiche della malattia cronica. Essa può evolvere quindi verso le forme più gravi, ovvero cirrosi ed epatocarcinoma, che portano alla morte con maggiore frequenza. Le manifestazioni cliniche possono andare da un quadro di infezione acuta con tasso di mortalità molto basso e legato all’insufficienza epatica acuta, alla forma acuta che però risolve nel 40-50% dei casi, alla forma cronica che interessa più della metà di soggetti infetti”.
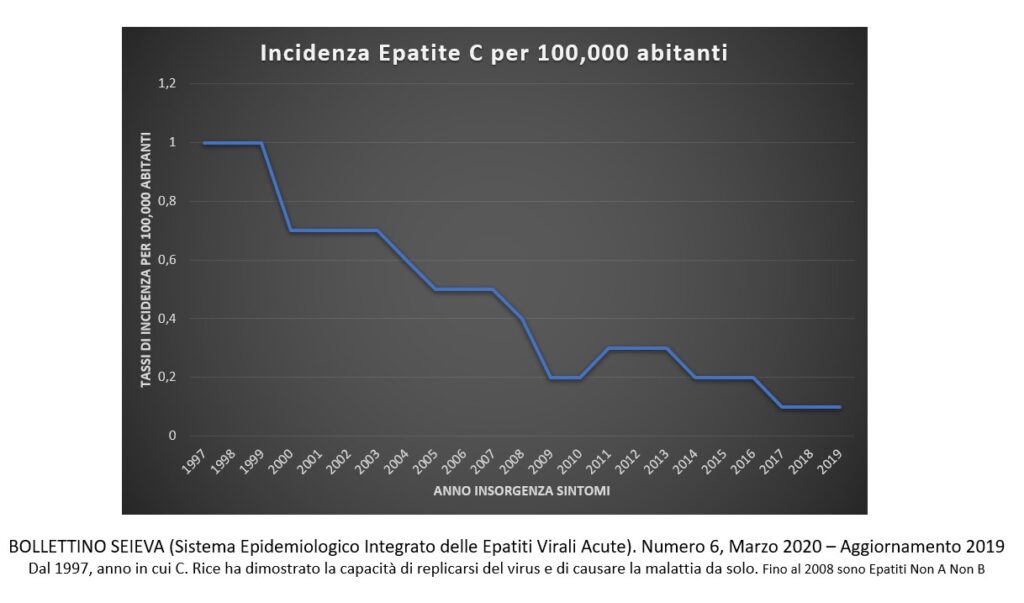
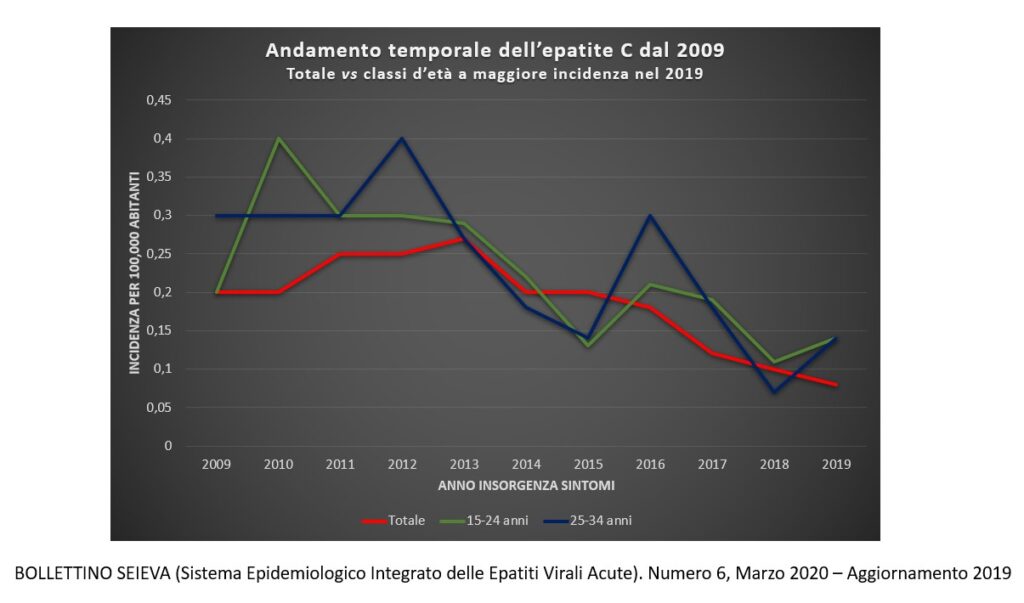
Oggi l’Oms ritiene questa malattia sia una delle principali cause di cancro del fegato, correlazione peraltro già dimostrata alla fine degli anni’80 da Houghton e collaboratori. Come si presenta la malattia e quando evolve verso la cirrosi epatica? Il fegato è il solo organo coinvolto?
“In realtà la malattia da virus dell’epatite C è sistemica, quindi capace di infettare non solo il fegato ma anche altri organi attraverso il processo infiammatorio indotto dallo stato di malattia cronica. In forma acuta si presenta come un’epatite di breve durata. Una percentuale davvero minima di pazienti (inferiore allo 0,1%) va incontro a un’insufficienza epatica acuta e quindi alla morte per epatite fulminante. Nella maggioranza dei casi, invece, la malattia o guarisce precocemente o va incontro alla cronicità. Cronicità significa che il paziente convive, anche per 20-30 anni, con un’infezione che non dà grandi segni della sua presenza e che quindi non è clinicamente riconoscibile se non nelle fasi molto avanzate, dopo un periodo di tempo dell’ordine di decadi. È una malattia subdola e in assenza di segni specifici della patologia, il paziente conduce una vita perfettamente normale, fino al momento in cui si manifestano i segni che portano alla diagnosi. Questo andamento non è però costante. Può coinvolgere dal 10 al 20% delle persone infettate, ma il numero può diventare rilevante nei momenti di picco di diffusione della malattia ed essere anche significativamente elevato nella popolazione generale. E guardando il numero di decessi per cirrosi ed epatocarcinoma, si nota l’elevata incidenza dell’infezione da virus dell’epatite C”.
Possono quindi esserci manifestazioni extraepatiche?
“Il coinvolgimento degli altri organi non è marginale: ci sono sistemi dell’organismo coinvolti in modo importante da questo virus. Ad esempio, l’associazione più certa tra presenza del virus e patologia non epatica è quella con il “linfoma a grandi cellule B”, una patologia oncologica del sangue della quale il virus è uno dei principali responsabili. Altro organo colpito è il rene nel quale il virus dell’epatite C può determinare, nel tempo, un danno non reversibile. Mentre il fegato guarisce e torna a una condizione di quasi normalità (è un organo in grado di rigenerare le sue cellule dopo che sono state danneggiate se la causa del danno viene rimossa), nel rene il processo di recupero non può avvenire per via della sua struttura. Dunque, il paziente con danno renale da epatite C cronica recupera solo marginalmente la funzione renale di filtro, quindi diventa particolarmente importante arrivare a fare diagnosi prima che questo danno si determini. Anche il cuore può essere coinvolto da un’infezione da virus dell’epatite C: in questo caso, l’azione lesiva del virus non è tanto sull’organo in sé, ma è legata all’aumento del rischio aterogeno, cioè che si formino trombi che ostruiscono i vasi sanguigni. Esiste poi una costellazione di patologie correlate alla presenza di questa infezione, tutt’altro che relegate al tessuto epatico, che aumentano la fragilità dell’individuo: dai disturbi endocrinologici, all’insorgenza di patologie con componente auto-immunitaria, alle porfirie (malattie metaboliche rare), a danno neurologico con ridotta capacità di lavoro intellettuale, minore efficienza nello svolgimento del lavoro quotidiano, con coinvolgimento anche della sfera cognitiva. Quanto detto fa capire come questo virus sia molto complesso e molto abile, con una intelligenza biologica e potenziali capacità di danno davvero straordinarie”.
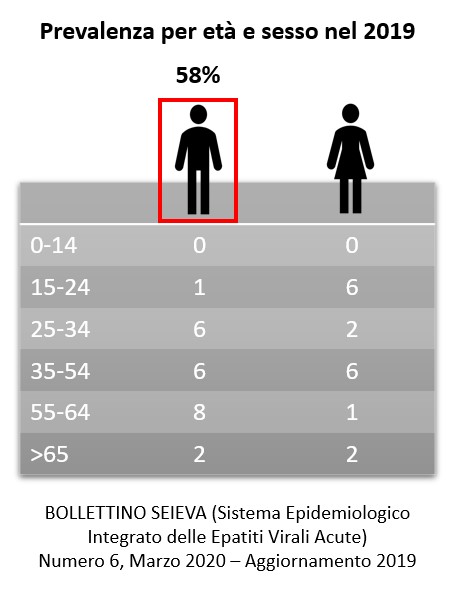

In Italia il miglioramento delle condizioni socioeconomiche, il maggior uso di materiale medico monouso e l’impiego dei test di screening (sierologico e molecolare) hanno cambiato il quadro epidemiologico, ma qual è la situazione attuale dell’epatite C in Italia?
“Ci sono sia buone che cattive notizie. Le buone notizie sono che nella popolazione in generale il virus ormai gioca un ruolo davvero marginale, perché le modalità di acquisizione dell’infezione sono per lo più limitate ad alcune categorie di soggetti più a rischio, cioè a coloro che per stile di vita, abitudini e comportamenti sono più suscettibili. Il miglioramento delle condizioni e del benessere sociali, nella popolazione generale, e l’accesso a strumenti molto più controllati, in ambito medico, hanno fatto sì che l’incidenza della malattia sia oggi ormai del tutto marginale. Tuttavia, ed eccoci alle cattive notizie, il virus continua a circolare dove ci sono comportamenti a rischio, come nel caso di tossicodipendenza e promiscuità sessuale, ma non abbiamo ancora messo a punto strategie di controllo efficaci per questi casi. Tali strategie implicano lo screening e il trattamento dei soggetti a rischio per ridurre la circolazione del virus. Occorre dunque un investimento economico nella diagnostica, nelle risorse umane e nell’approvvigionamento dei farmaci che servono per l’abbattimento della prevalenza dell’infezione in questi casi. Attualmente, con la disponibilità di farmaci estremamente efficaci stiamo mirando all’eradicazione dell’infezione nel singolo paziente con tassi di guarigione che sfiorano il 99%. Questo è un risultato straordinario perché non c’è quasi nessun’altra malattia che abbia un simile tasso di efficacia delle cure. Abbiamo raggiunto un traguardo davvero quasi inimmaginabile da quando il virus è stato identificato nel 1989 e da quando abbiamo iniziato a trattarlo con la terapia classica che inizialmente era rappresentata dall’interferone e poi dall’associazione interferone e ribavirina”.
Analogamente alla storia della scoperta del virus, anche la storia della terapia dell’epatite C è progredita per tappe, a partire dall’interferone, come ci anticipava. Può ripercorrerla con noi per capire come sono cambiate le terapie nel tempo?
“Via via che è stata fatta una mappatura dei pazienti con infezione da epatite C (e realizzata la necessità di tentare di arrivare alla guarigione) ci siamo accorti che l’interferone, già usato per i pazienti con l’epatite B, poteva funzionare anche in questo caso. Proseguendo negli anni le sperimentazioni si è realizzato poi che esisteva un altro farmaco, già utilizzato per il virus respiratorio sinciziale, che poteva essere utile anche per l’infezione da epatite C, non tanto da solo quanto associato all’interferone: la ribavirina. Verso la metà degli anni ’90 del Novecento l’associazione con ribavirina si è dimostrata nettamente più vantaggiosa rispetto al solo interferone nel trattamento della malattia. In seguito, si è anche imparato a usare i farmaci in maniera più efficace, direi più intelligente, modulando la durata della terapia e il dosaggio dei farmaci sulla base di alcune caratteristiche sia del virus che dei pazienti. Si è così ridotta al minimo l’esposizione dei pazienti agli effetti collaterali di queste terapie (che sono piuttosto considerevoli), ottimizzando la risposta soltanto nei pazienti che dimostravano una certa attitudine a combattere efficacemente il virus con questi farmaci. Abbiamo quindi fatto quella che si chiama una “customizzazione” ossia abbiamo ritagliato la terapia sulle caratteristiche del singolo paziente e dell’infezione. Questo perché si è capito che i genotipi esistenti di questo virus non sono tutti uguali per severità e progressione di malattia, ma anche per sensibilità al trattamento con interferone e ribavirina. È stato un percorso lungo che ha richiesto anni di studio, di approfondimenti e dibattiti, ma alla fine siamo riusciti ad avere delle regole che hanno permesso di ottenere risultati abbastanza soddisfacenti. Sono comparsi all’orizzonte anche i farmaci antivirali diretti più efficaci e più aggressivi nei confronti del virus, ma che presentavano effetti collaterali considerevoli (rilevante tossicità) e un livello di tollerabilità sempre più faticoso da accettare per i pazienti. E anche in questa fase, ci siamo resi conto che la parola chiave era “customizzazione”, cioè adattare il regime terapeutico (e l’insistenza con cui il regime terapeutico veniva proposto ai singoli pazienti) alle caratteristiche sia del virus che del paziente”.
I farmaci sono efficaci nello stesso modo in tutti i pazienti? Esistono linee guida per il loro trattamento?
“Questo è stato vero per un po’ di anni, fino a quando non abbiamo inserito nelle terapie l’interferone. L’interferone, infatti, nella sua attività antivirale, non fa tutto da solo, ma si avvale di una “strumentazione” caratteristica del singolo individuo infetto. È come dire che noi gettiamo un seme in un terreno che può essere roccioso, sabbioso o di terra fertile: i risultati che otterremo sono nettamente diversi in un caso o nell’altro. Conoscere, quindi, la differente natura e composizione del terreno ha comportato la modulazione dell’utilizzo di questi farmaci. Sono poi comparsi, nella prima decade degli anni duemila, farmaci completamente diversi, con assoluta ed esclusiva azione antivirale e, con un migliorato profilo di tollerabilità tale per cui, oggi, si è capito che esistono terapie che prescindono dal profilo genotipico del paziente infettato, dalle caratteristiche biologiche e dal profilo metabolico dei pazienti trattati. Con tali farmaci guariscono più di 9 pazienti su 10”.
Nell’intervista subito dopo la comunicazione dell’assegnazione del premio Nobel, Houghton ha dichiarato che guardando ai numeri dell’epatite C, e ora del Covid-19, si comprende che per controllare una pandemia serve un vaccino. Che ci può dire su questo?
“Trovare un vaccino per l’epatite C non è più una priorità per la semplice ragione che l’obiettivo di rendere il mondo (virtualmente) libero dall’epatite C è conseguibile (non in tempi brevissimi ma nel medio e lungo periodo) anche senza un vaccino, intervenendo sui gruppi di popolazioni più a rischio come detto precedentemente. Inoltre, dovremmo cominciare a pensare a un vaccino in modo diverso da come siamo abituati. A questo proposito vorrei ricordare quello che dice il ricercatore Leor Weinberger in uno dei suoi “ted talks”: “è inutile che noi continuiamo a fare i vaccini come li abbiamo sempre fatti. Dobbiamo abituarci a pensare che quello che fa un virus lo deve fare anche il vaccino. Si deve quindi trasmettere da una persona all’altra e deve mutare esattamene come fa il virus, che si trasmette e muta”. E questo approccio, a mio avviso geniale e interessatissimo, probabilmente sarà la chiave per la creazione di una serie di vaccini per virus che hanno una alta capacità di mutazione e quindi di sfuggire a una risposta immunitaria creata con un vaccino statico. Il virus è dinamico e c’è quindi bisogno di un vaccino dinamico. Oggi questo non è alla nostra portata, ma lo sarà in un futuro non so quanto lontano e che vedrà forse proprio lo sviluppo, l’elaborazione e la crescita di nuove tecnologie. Ma comunque non sarà più una priorità per l’epatite C, perché nel giro di una cinquantina d’anni la malattia sarà probabilmente marginalizzata in modo molto efficace dalle terapie”.
Contrastare la diffusione dell’epatite C: prevenzione e test diagnostici. Come e quando?
“La prevenzione è fortemente legata a un cambiamento di stile di vita di alcune gruppi della popolazione. Quello che possiamo fare per arginare la diffusione del virus è svuotare i serbatoi, identificandoli, circoscrivendoli e lavorando in modo sistematico all’interno delle comunità nelle quali il virus circola e viene trasmesso, affinché scompaia. Per farlo abbiamo bisogno di un sistema che sia efficace ed efficiente. L’efficacia l’abbiamo: le terapie funzionano. L’efficienza dipende dalla capacità di raggiungere queste comunità mediante un’azione di identificazione dei soggetti infetti e del loro trattamento sistematico, quasi in simultanea, perché abbattere del 90-95% l’entità della circolazione del virus nei gruppi di persone più a rischio significa fondamentalmente svuotare il serbatoio e ridurre la possibilità di trasmissione dell’infezione”.
Come si cura
I primi farmaci impiegati per il trattamento di questa infezione epatica sono stati l’interferone e ribavirina. Gli interferoni (così chiamati da Alick Isaacs e Jean Lindenmann nel 1957 perché inteferivano con il virus che attaccava una cellula) sono proteine prodotte dal sistema immunitario che inibiscono la replicazione del virus all’interno della cellula e impediscono che si diffonda alle altre cellule. La ribavirina, invece, è una molecola che induce errori nella replicazione virale confondendo il virus perché è simile a una molecola di cui ha bisogno per replicarsi.
Questi due farmaci venivano usati in combinazione per una terapia lunga e di efficacia non sempre certa e con importanti e frequenti effetti collaterali. Le cose non sono migliorate neanche con l’introduzione dell’interferone pegilato. Il processo di pegilazione è una modifica della molecola di interferone che rende possibile ridurre la somministrazione del farmaco, allungando i tempi di presenza nel circolo ematico, senza alterarne l’efficacia.
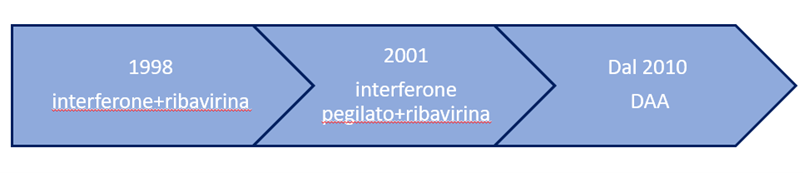
La rivoluzione nella terapia dell’epatite C è arrivata con i farmaci antivirali ad azione diretta (Daa, direct acting antivirals) − di prima e seconda generazione − che mostrano una buona tollerabilità ed efficacia in circa il 90% dei pazienti. Questi farmaci agiscono inibendo tappe cruciali del ciclo vitale del virus: il materiale genetico del virus codifica per una poliprotreina che poi viene divisa per formare proteine strutturali e non che hanno funzioni diverse per la sopravvivenza del virus. Se queste proteine vengono bloccate si interrompe la replicazione del virus.
Esistono tre diversi classi di questi farmaci, distinte in relazione al diverso bersaglio che colpiscono. In Italia, con la determina n.500 del marzo 2017, la rimborsabilità dei Daa è stata estesa a tutti i pazienti con Hcv, indipendentemente dal grado di malattia. Al 5 ottobre, quando Alter, Houghton e Rice ricevevano la notizia dell’assegnazione del Nobel, il registro dell’Agenzia italiana del farmaco (Aifa) riportava 213.730 trattamenti attivi.






















Commenti recenti